
- Συγγραφέας Stanley Ellington [email protected].
- Public 2023-12-16 00:15.
- Τελευταία τροποποίηση 2025-01-22 15:56.
Τα καρβοξυλικά οξέα έχουν υψηλή σημεία βρασμού σε σύγκριση με άλλες ουσίες παρόμοιας μοριακής μάζας. Σημεία βρασμού αυξάνεται με τη μοριακή μάζα. Τα καρβοξυλικά οξέα που έχουν ένα έως τέσσερα άτομα άνθρακα είναι πλήρως αναμίξιμα με το νερό. Η διαλυτότητα μειώνεται με τη μοριακή μάζα.
Επίσης το ερώτημα είναι ποιες είναι οι χημικές ιδιότητες του καρβοξυλικού οξέος;
Ιδιότητες καρβοξυλικών οξέων . Καρβοξυλικά οξέα είναι διαλυτά στο νερό. Καρβοξυλικά οξέα δεν διμερίζονται στο νερό, αλλά σχηματίζουν δεσμούς υδρογόνου με το νερό. Καρβοξυλικά οξέα είναι πολικές και λόγω της παρουσίας του υδροξυλίου στο καρβοξυλ ομάδα, είναι σε θέση να σχηματίσουν δεσμούς υδρογόνου με μόρια νερού.
Στη συνέχεια, το ερώτημα είναι ποιες είναι οι ιδιότητες της καρβοξυλικής ομάδας; Ιδιότητες Καρβοξυλομάδας Καρβοξυλομάδα αποτελείται από ηλεκτραρνητικό διπλό δεσμό οξυγόνου με ένα άτομο άνθρακα. Ως αποτέλεσμα, θα υπάρξει αύξηση της πολικότητας ενός δεσμού. Μια ένωση που περιλαμβάνει α καρβοξυλική ομάδα θα έχει υψηλό σημείο τήξης, υδρόφιλα κέντρα και σημείο βρασμού.
Γνωρίζετε επίσης, ποια είναι η πιο σημαντική χημική ιδιότητα των καρβοξυλικών οξέων;
Ο ΑΡΧΗΓΟΣ χημική ουσία χαρακτηριστικό του καρβοξυλικά οξέα είναι η οξύτητά τους. Είναι γενικά πιο όξινα από άλλες οργανικές ενώσεις που περιέχουν υδροξυλομάδες, αλλά είναι γενικά πιο αδύναμα από τα γνωστά ορυκτά οξέα (π.χ. υδροχλωρικό οξύ , HCl, θειικό οξύ , Χ2ΕΤΣΙ4, και τα λοιπά.).
Ποιες είναι οι χημικές ιδιότητες των εστέρων;
Εστέρες , όπως οι αλδεΰδες και οι κετόνες, είναι πολικά μόρια και έτσι έχουν αλληλεπιδράσεις διπόλου-διπόλου καθώς και δυνάμεις διασποράς van der Waals. Ωστόσο, δεν σχηματίζουν δεσμούς υδρογόνου εστέρα-εστέρα, επομένως τα σημεία βρασμού τους είναι σημαντικά χαμηλότερα από αυτά ενός οξέος με τον ίδιο αριθμό ατόμων άνθρακα.
Συνιστάται:
Ποιο είναι το πιο δραστικό παράγωγο καρβοξυλικού οξέος;
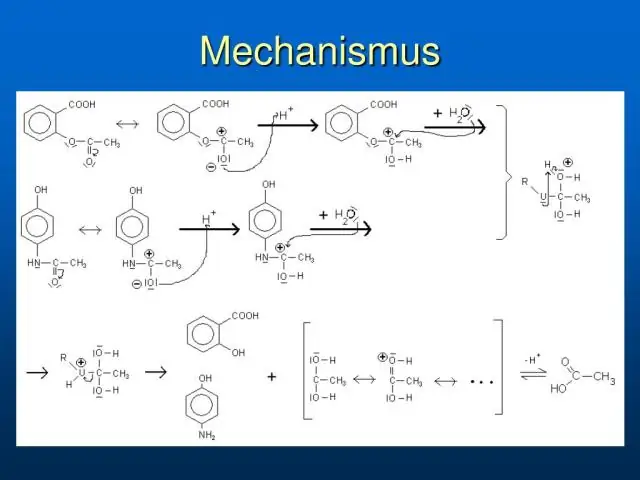
Διαφορετικά παράγωγα καρβοξυλικού οξέος έχουν πολύ διαφορετική δραστικότητα, τα ακυλοχλωρίδια και βρωμίδια είναι τα πιο δραστικά και τα αμίδια τα λιγότερο δραστικά, όπως σημειώνεται στον παρακάτω ποιοτικά ταξινομημένο κατάλογο. Η αλλαγή στην αντιδραστικότητα είναι δραματική
Ποια είναι η διαφορά μεταξύ του κύκλου Krebs και του κύκλου κιτρικού οξέος;
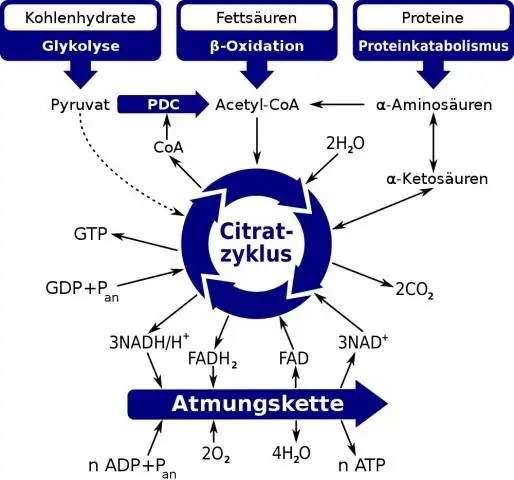
Η κύρια διαφορά μεταξύ γλυκόλυσης και κύκλου Krebs είναι: Η γλυκόλυση είναι το πρώτο βήμα που εμπλέκεται στη διαδικασία της αναπνοής και εμφανίζεται στο κυτταρόπλασμα του κυττάρου. Από την άλλη πλευρά, ο κύκλος Kreb ή ο κύκλος του κιτρικού οξέος περιλαμβάνει την οξείδωση του ακετυλικού CoA σε CO2 και H2O
Ποια είναι η χρήση του καρβοξυλικού οξέος;
Τα παράγωγα καρβοξυλικού οξέος έχουν ποικίλες εφαρμογές. Για παράδειγμα, εκτός από τη χρήση του ως απολυμαντικό, το μυρμηκικό οξύ, το απλούστερο καρβοξυλικό οξύ, χρησιμοποιείται στην επεξεργασία υφασμάτων και ως παράγοντας μείωσης του οξέος. Το οξικό οξύ χρησιμοποιείται εκτενώς στην παραγωγή πλαστικών και εστέρων κυτταρίνης
Ποια είναι η διαφορά μεταξύ μιας αλδεΰδης μιας κετόνης και ενός καρβοξυλικού οξέος;

Οι αλδεΰδες και οι κετόνες περιέχουν την καρβονυλική λειτουργική ομάδα. Σε μια αλδεΰδη, το καρβονύλιο βρίσκεται στο τέλος μιας ανθρακικής αλυσίδας, ενώ σε μια κετόνη, βρίσκεται στη μέση. Ένα καρβοξυλικό οξύ περιέχει την καρβοξυλική λειτουργική ομάδα
Γιατί το σχήμα της καμπύλης ογκομέτρησης ήταν διαφορετικό για την τιτλοδότηση ισχυρού οξέος έναντι ισχυρής βάσης και ασθενούς οξέος έναντι ισχυρής βάσης;

Το γενικό σχήμα της καμπύλης ογκομέτρησης είναι το ίδιο, αλλά το pH στο σημείο ισοδυναμίας είναι διαφορετικό. Σε μια τιτλοδότηση ασθενούς-ισχυρής βάσης, το pH είναι μεγαλύτερο από 7 στο σημείο ισοδυναμίας. Σε μια τιτλοδότηση ισχυρής ασθενούς βάσης, το pH είναι μικρότερο από 7 στο σημείο ισοδυναμίας
